Phương trình ion là gì? Hướng dẫn cách cân bằng phương trình ion rút gọn đơn giản, dễ hiểu.
Trong các phương trình phản ứng, một phương trình ion sẽ thể hiện ngắn gọn bản chất của các chất phản ứng. Một điều hiển nhiên là ta phải cân bằng các phương trình, dù là phương trình đầy đủ hay phương trình ion rút gọn.
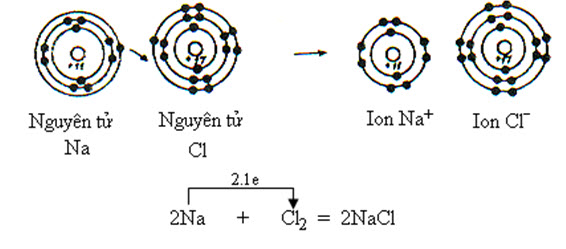
Ví dụ liên kết ion giữa 2 nguyên từ Na và Cl
Ở các phương trình phân tử, cân bằng phương trình phải đảm bảo sự bảo toàn của các nguyên tố trước và sau phản ứng. Nhưng ở phương trình ion rút gọn, k chỉ đảm bảo sự bảo toàn của các nguyên tố, mà còn phải đảm bảo sự bảo toàn điện tích của các nguyên tố đó.
Cách cân bằng phuong trình ion rút gọn sẽ đem lại hiệu quả trong tính toán hóa học. Tuy nhiên, để xây dựng được phương trình ion rút gọn, bản phải viết đúng phương trình phân tử và phương trình ion đầy đủ.
Ví dụ 1: MgCl2 + 2AgNO3 ® Mg(NO3)2 + 2AgCl ¯
Phương trình ion: Mg[2+] + 2Cl[-] + 2Ag[+] + 2NO3[-] ® Mg[2+] + 2NO3[-] + 2AgCl ¯
PT ion rút gọn: 2Ag[+] + 2C[l]- ® 2AgCl ¯
đơn giản hệ số: Ag[+] + Cl[-] ® AgCl ¯
=> Như vậy có 1 cách “không cần cân bằng phương trình ion rút gọn” đó là bạn chỉ việc viết lại các hệ số từ phương trình phân tử. Muốn được như vậy, đề bài ban đầu phải cho trước phương trình phân tử. Bạn đã nhìn thấy đấy, bản chất của phản ứng rất đơn giản đó là sự kết hợp của ion Ag[+] và ion Cl[-] tạo thành kết tủa AgCl.
Cũng ở ví dụ trên, nếu bạn nhìn ra nhanh được bản chất của phản ứng thì rõ ràng bạn không cần phải trải qua rất nhiên bước như vậy.
Ví dụ 2: CaCO3 + 2H[+] ® Ca[2+] + CO2 + H2O
=>Đây là một phương trình ion rút gọn, thể hiện phản ứng trao đổi giữa muối và ion H[+] tạo thành chất điện li yếu. Cách cân bằng phương trình khá đơn giản. Các nguyên tố hay điện tích của chúng đều được bảo toàn.
Ví dụ 3: 3Cu + 8H[+] + 2NO3[-] ® 3Cu[2+] + 2NO + 4H2O
=> Đây là một phản ứng oxi hóa khử. Để cân bằng phương trình ta phải biết rõ các quá trình oxi hóa và quá trình khử.
.jpg)
Đặt hệ số nhân chéo là các electron trao đổi như trên. Sau đó nhân hệ số lần lượt vào các chất Cu, Cu[2+], NO3[-], NO. Sau đó tính H và O sao cho đảm bảo cân bằng nguyên tố và điện tích.
Đặc biệt với phương trình trên ta lại có một cách nhớ các hệ số cơ bản như 1 “câu thần chú” đó là “3 đồng 8 H 2 no”.
Dưới đây là một số các phương trình ion rút gọn đã cân bằng:
Để cân bằng các phương trình ion rút gọn, các em cần chú ý đến điện tích của các nguyên tố. qua phương trình rút gọn, các em cũng dễ dàng thấy rõ được bản chất của các phản ứng. Hy vọng các em sẽ nắm vững kiến thức và cân bằng các phương trình một cách nhanh chóng. Chúc các em học tốt.
Xem thêm: Các chất điện li yếu thường gặp
Trong các phương trình phản ứng, một phương trình ion sẽ thể hiện ngắn gọn bản chất của các chất phản ứng. Một điều hiển nhiên là ta phải cân bằng các phương trình, dù là phương trình đầy đủ hay phương trình ion rút gọn.

Ví dụ liên kết ion giữa 2 nguyên từ Na và Cl
Ở các phương trình phân tử, cân bằng phương trình phải đảm bảo sự bảo toàn của các nguyên tố trước và sau phản ứng. Nhưng ở phương trình ion rút gọn, k chỉ đảm bảo sự bảo toàn của các nguyên tố, mà còn phải đảm bảo sự bảo toàn điện tích của các nguyên tố đó.
Cách cân bằng phuong trình ion rút gọn sẽ đem lại hiệu quả trong tính toán hóa học. Tuy nhiên, để xây dựng được phương trình ion rút gọn, bản phải viết đúng phương trình phân tử và phương trình ion đầy đủ.
Ví dụ 1: MgCl2 + 2AgNO3 ® Mg(NO3)2 + 2AgCl ¯
Phương trình ion: Mg[2+] + 2Cl[-] + 2Ag[+] + 2NO3[-] ® Mg[2+] + 2NO3[-] + 2AgCl ¯
PT ion rút gọn: 2Ag[+] + 2C[l]- ® 2AgCl ¯
đơn giản hệ số: Ag[+] + Cl[-] ® AgCl ¯
=> Như vậy có 1 cách “không cần cân bằng phương trình ion rút gọn” đó là bạn chỉ việc viết lại các hệ số từ phương trình phân tử. Muốn được như vậy, đề bài ban đầu phải cho trước phương trình phân tử. Bạn đã nhìn thấy đấy, bản chất của phản ứng rất đơn giản đó là sự kết hợp của ion Ag[+] và ion Cl[-] tạo thành kết tủa AgCl.
Cũng ở ví dụ trên, nếu bạn nhìn ra nhanh được bản chất của phản ứng thì rõ ràng bạn không cần phải trải qua rất nhiên bước như vậy.
Ví dụ 2: CaCO3 + 2H[+] ® Ca[2+] + CO2 + H2O
=>Đây là một phương trình ion rút gọn, thể hiện phản ứng trao đổi giữa muối và ion H[+] tạo thành chất điện li yếu. Cách cân bằng phương trình khá đơn giản. Các nguyên tố hay điện tích của chúng đều được bảo toàn.
Ví dụ 3: 3Cu + 8H[+] + 2NO3[-] ® 3Cu[2+] + 2NO + 4H2O
=> Đây là một phản ứng oxi hóa khử. Để cân bằng phương trình ta phải biết rõ các quá trình oxi hóa và quá trình khử.
.jpg)
Đặt hệ số nhân chéo là các electron trao đổi như trên. Sau đó nhân hệ số lần lượt vào các chất Cu, Cu[2+], NO3[-], NO. Sau đó tính H và O sao cho đảm bảo cân bằng nguyên tố và điện tích.
Đặc biệt với phương trình trên ta lại có một cách nhớ các hệ số cơ bản như 1 “câu thần chú” đó là “3 đồng 8 H 2 no”.
Dưới đây là một số các phương trình ion rút gọn đã cân bằng:
- Al [3+] + 3NH3 + 3H2O ® Al(OH)3 + 3NH4[+]
- H3O[+] + OH[-] ® 2H2O
- OH[- ] + HCO3[- ] ® CO3[2-] + H2O
- HCO3[−] + H[+] ® H2O + CO2
- Ag + 2H[+] + NO3[-] ® Ag[+] + NO2 + H2O
- Al + 6 H[+] + 3 NO3[-] → Al[3+] + 3 NO2 + 3 H2O
- Fe + 2 H[+] → Fe[2+] + H2
- 2 Fe + 8 H[+] + SO4[2-] → 2 Fe[3+] + S + 4 H2O
Để cân bằng các phương trình ion rút gọn, các em cần chú ý đến điện tích của các nguyên tố. qua phương trình rút gọn, các em cũng dễ dàng thấy rõ được bản chất của các phản ứng. Hy vọng các em sẽ nắm vững kiến thức và cân bằng các phương trình một cách nhanh chóng. Chúc các em học tốt.
Xem thêm: Các chất điện li yếu thường gặp